Si eres de los que siempre se ha preguntado cómo se sabe qué elementos químicos hay en las estrellas, estás en el post adecuado. La espectroscopía es la herramienta que se usa para dar respuesta a esta pregunta, pero ¿qué es?
Empecemos por el principio. La luz es una onda electromagnética, esto es, una onda que no necesita un medio para propagarse. Cada onda se caracteriza por su longitud de onda (la distancia entre dos máximos o dos mínimos consecutivos) o por su frecuencia (en un cierto tiempo, cuántas veces oscila la onda). A mayor frecuencia, y por tanto menor longitud de onda, más energía transporta la onda.
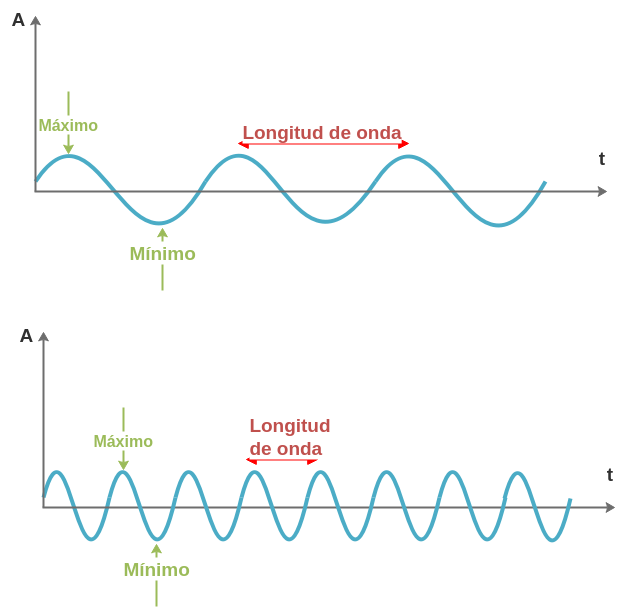
Dentro de lo que los físicos llamamos luz, hay todo un abanico de ondas electromagnéticas con diferentes longitudes de onda. Para ordenar este maremagnum, hemos establecido el
Espectro electromagnético
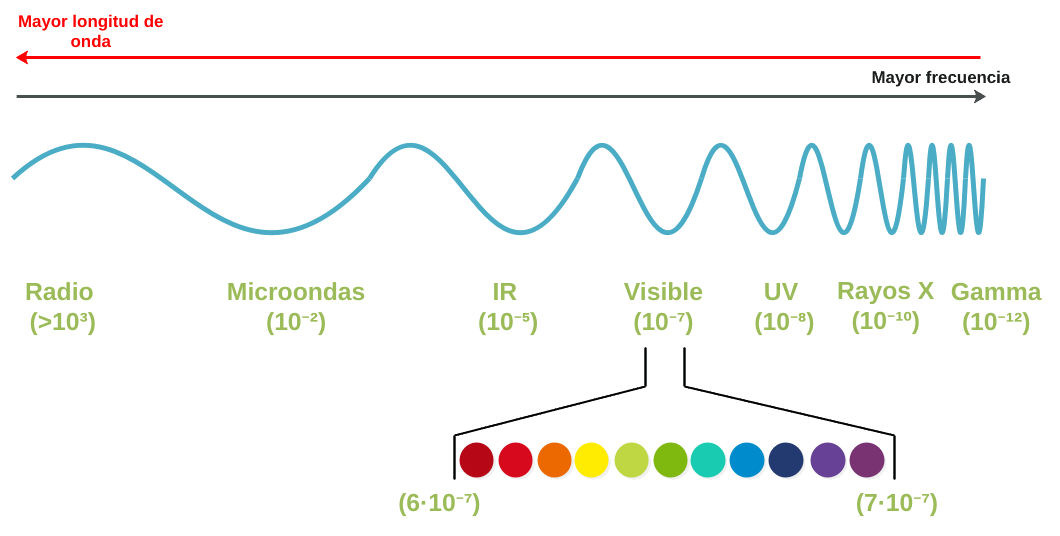
Así, vamos de ondas cada vez menos energéticas (Ondas de radio, con las que escuchamos la radio en el coche) hasta las más energéticas (Rayos gamma), pasando por la parte que usamos para calentar el colacao en el microondas, la parte con la que funciona en mando a distancia de la tele (IR-infrarrojo), la parte que nuestros ojos están preparados para ver y donde se incluyen todos los colores (Visible), aquella con la que nos ponemos morenos en la playa (UV-ultravioleta) y la que nos hace radiografías (Rayos X).
Viendo esto, es fácil entender qué ocurre cuando aparece un arco-iris en el cielo: las gotas de luz actúan de prisma refractando la luz y separándola en todas las longitudes de onda, como si abriese un abanico. Es lo mismo que podéis ver en este vídeo con el prisma de Newton:
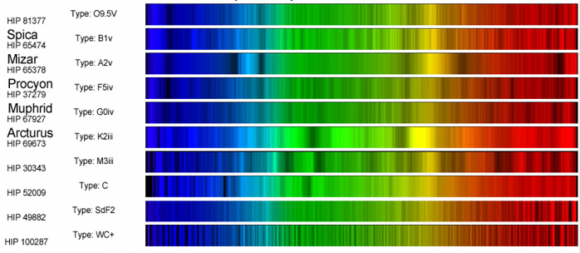
Pues bien, algo parecido hizo Fraunhofer en 1214: usó un espectógrafo para analizar la luz del Sol. Un espectrógrafo es un utensilio que contiene un prisma o una rejilla de difracción y descompone la luz en todas las longitudes de onda que contenga, proyectándola sobre una pantalla, de manera que lo que se ve son líneas, cada una correspondiente a una longitud de onda. Fraunhofer esperaba encontrar un arco-iris completo, es decir, un espectro continuo, esperaba que la luz del Sol contuviera todos los colores. Sin embargo lo que observó fue extraño.
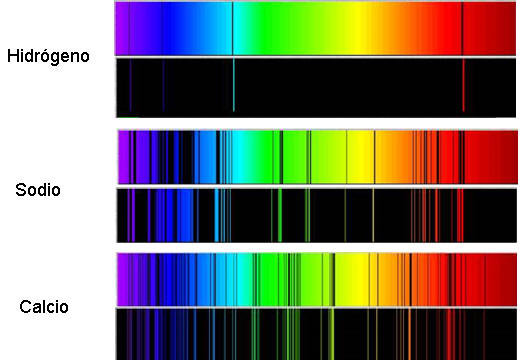
En el espectro del Sol faltaban líneas
La explicación a estas líneas ‘robadas’ en el espectro solar la darían unos años más tarde, en 1859, Kirchhoff y Bunsen. En su experimento, ellos lanzaban luz blanca a través de una cámara sellada que contenía gas de algún elemento químico. Al otro lado del gas había un espectrógrafo. Observaron que según el elemento químico que tenía que atravesar la luz, en el espectro continuo faltaban unas líneas concretas, únicas para cada elemento, como si fuera un código de barras que nos ayuda a identificar el elemento que había en la cámara.
Cada elemento tiene asociado unas líneas espectrales concretas y únicas
Esto es lo que ocurre cuando la luz atraviesa un gas frío, el gas absorbe determinadas energías, es decir, determinadas longitudes de onda, por lo que este espectro de arco-iris al que le han robado algunas líneas se llama espectro de absorción. También puede ocurrir que un gas caliente de un determinado elemento emita también en esas determinadas longitudes de onda, y entonces de llama espectro de emisión. Ambos son complementarios, es decir, si se suman, darán como resultado el espectro continuo.
Ahora bien, ¿por qué un elemento absorbe o emite en esas líneas concretas, en esas energías concretas? La respuesta la encontramos en el modelo atómico de Bohr. En este modelo encontramos protones y neutrones formando un núcleo alrededor del cual giran los electrones. Lo más novedoso de este modelo es que impone la cuantización de los niveles de energía: los electrones no podrán estar en cualquier órbita alrededor del núcleo, sino sólo en aquellas órbitas permitidas según la energía que tienen. Cuanto más lejos del núcleo, mayor es la energía. Un electrón puede pasar a una órbita de mayor energía si se le proporciona exactamente la energía necesaria para ese salto. También puede pasar a una órbita de menos energía si se desprende de la diferencia de energía entre ambas órbitas.
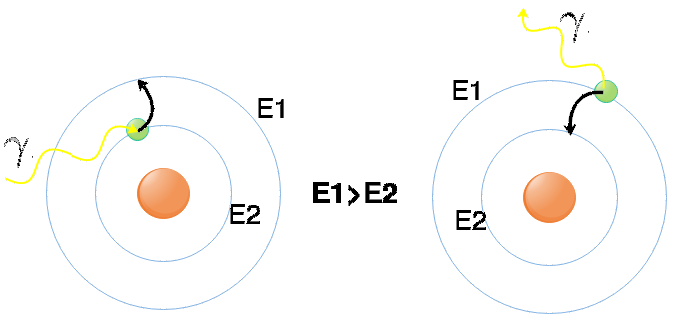
Para cada elemento químico estos niveles energéticos son diferentes. Cuando incide luz sobre los átomos de un elemento químico, los electrones adquieren las energías concretas para saltar a orbitales de mayor energía, produciéndose el espectro de absorción. Cuando los átomos están excitados, es decir, tienen sus electrones en orbitales de alta energía, pueden volver al estado fundamental emitiendo la energía sobrante en cada salto a una órbita de menos energía, produciéndose un espectro de emisión.
Este es el que puede considerarse el nacimiento de la Astrofísica como tal, el momento en el que se comprende que analizando la luz de las estrellas se puede obtener un montón de información, como por ejemplo, qué elementos químicos contienen. Así es como se sabe de qué están hechas las estrellas.

(La fecha sobre Fraunhofer es errónea)
Claro, conciso; muy bien.